Математическое моделирование поможет победить рак
Из-за онкологических заболеваний ежегодно умирает около десяти миллионов человек. Разработка эффективных методов лечения рака является для современной медицины важнейшей, но крайне трудной задачей, из-за сложности и невероятного разнообразия злокачественных опухолей. Мы часто слышим в новостях об открытии новых методов лечения рака, но каждый из них слабо доступен широким массам из-за своей дороговизны, и кроме того, каждый из них направлен лишь на узкий круг онкологических заболеваний и имеет ограниченную эффективность. К примеру, успех нового метода из области иммунотерапии, авторам которого в прошлом году была присуждена Нобелевская премия, заключается в значительном уменьшении объема опухолей (не всегда означающем полное выздоровление) лишь у примерно трети пациентов с меланомой и раком почки.
Это означает, что классические методы лечения – такие, как химиотерапия и радиотерапия – будут востребованы еще долгое время. Поэтому важную роль в онкологии играет поиск комбинаций классических видов терапии с высокой итоговой противоопухолевой эффективностью, решающее влияние на которую оказывает расписание введения препаратов или совершения других медицинских действий. Формально для такого поиска требуется проведение колоссального количества клинических испытаний, использующих различные протоколы, для каждого исследуемого набора терапий и для каждого из типов рака. Эта задачу физически невозможно выполнить, более того, она связана с определенными этическими трудностями, так как результат взаимодействия препаратов вполне может и снизить общую эффективность терапии.

Стандартные и перспективные методы лечения онкологических заболеваний.
Существенную помощь в решении этой задачи может оказать относительно молодой подход в онкологии – математическое моделирование. Разумеется, оно ни в коем случае не может полностью заменить клинические исследования, но с помощью него можно существенно сузить круг потенциально эффективных схем лечения, требующих экспериментальной проверки. Исследованиями в этой области занимаются сотрудники Центра «Математическое моделирование в биомедицине» Максим Кузнецов и Андрей Колобов. Особое внимание они фокусируют на рассмотрении клинических схем, включающих антиангиогенную терапию, действие которой направлено на прекращение образования новых кровеносных сосудов, питающих опухоль. В теории такое воздействие должно приводить к ограничению притока питательных веществ к опухоли и замедлять ее рост.
Антиангиогенная терапия относится к классическим методам лечения, а именно – к группе таргетных терапий, цель которых – блокирование действия определенных «молекулярных мишеней», участвующих в росте опухоли. Вместе с этим она является довольно молодой и слабо изученной на практике терапией. Как правило, клинические испытания новых противоопухолевых препаратов сначала проводятся для опухолей высокой степени злокачественности – чтобы проверить лекарства в максимально трудных боевых условиях – и все антиангиогенные препараты оказались весьма малоэффективными для большинства таких опухолей. Но еще до осознания этого факта медицинским сообществом первый антиангиогенный препарат, авастин, получил клиническое одобрение для метастатически активной глиобластомы. И теперь в официальной информации по его назначению отмечено, что его применение в режиме монотерапии не увеличивает продолжительность жизни пациентов, позволяя на практике лишь несколько облегчить симптомы болезни. При этом последующие испытания анитиангиогенных препаратов продемонстрировали их значительную эффективность для доброкачественных опухолей. Такой же вывод относительно эффективности антиангиогенных препаратов для разных типов опухолей был независимо сделан нашими сотрудниками как раз с помощью математического моделирования.
Им удалось получить этот результат благодаря новому подходу к рассмотрению причин роста опухоли. В существующих математических моделях зачастую единственной причиной роста опухоли считается инвазия, т.е., прорастание раковых клеток в окружающую ткань. Этот тип роста характерен для опухолей высокой степени злокачественности. Потому такие опухоли сложно удалить хирургическим путем – оставшиеся клетки зачастую приводят к рецидиву болезни. Наши ученые, кроме этого, учитывают и другую причину – расталкивание окружающих тканей делящимися опухолевыми клетками. Этот тип роста имеет решающее значение для компактных доброкачественных опухолей. В процессе озлокачествления опухоли характер ее роста, как правило, изменяется с компактного на инвазивный, и рост реальной опухоли представляет собой комбинацию этих двух типов. Такой подход позволил нашим ученым мгновенно сделать выводы, на получение которых у медицинского сообщества ушло более десяти лет.
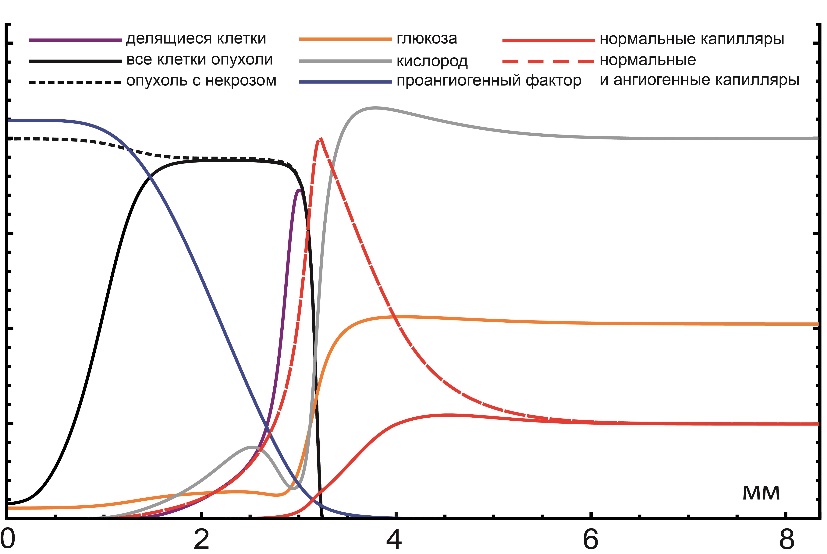
Пример распределения переменных в модели роста раковой опухоли
Теперь Максим и Андрей работают над моделированием комбинированного лечения, заключающегося в добавлении антиангиогенной терапии к химио- и радиотерапии. На практике такие методы лечения показывают неоднозначные результаты, так как разные виды противоопухолевой терапии взаимодействуют между собой довольно сложным образом: к примеру, антиангиогенная терапия может не только перекрыть поток питательных веществ к опухоли, но и снизить приток химиотерапевтического препарата. В целях наших ученых – определение ключевых факторов, влияющих на эффективность таких комбинированных лечений и предложение оптимальных клинических схем лечения. Тот факт, что модель уже доказала свою эффективность на деле, позволяет рассчитывать на значительные результаты и в этой задаче.